CONOCIENDO LA TABLA PERIÓDICA
- La tabla periódica moderna está relacionada con la configuración electrónica de los átomos.
- Los elementos están ordenados por su número atómico creciente
- Las filas horizontales se denominan períodos y las columnas verticales reciben el nombre de grupo.
- El número del período indica la cantidad de niveles energéticos (órbitas) que tienen los átomos de los elementos que se ubican en dicho período. Así, el H y el He que están en el período 1 tienen una sola órbita; el Li al estar en el período 2 cuenta con dos órbitas, etcétera.
- Todos los períodos empiezan con un elemento en el que comienza a llenarse un orbital s. Los períodos 2, 3, 4, 5 y 6 terminan con un gas noble en el que se completa un orbital p.
- Todos los elementos de un mismo grupo presentan igual configuración electrónica externa.
- Los elementos ubicados en un mismo grupo tienen propiedades químicas similares y sus propiedades físicas están relacionadas.
- En el grupo 18 se encuentran los gases inertes, también conocidos como gases raros o nobles, que se caracterizan por su inactividad química.
- A los elementos ubicados en el grupo I se los suele denominar metales alcalinos, con excepción del hidrógeno, que es no metal.
- Los elementos del grupo 17, menos el astato, reciben también el nombre de halógenos.
OBSERVACIONES GENERALES
-Al hidrógeno no se le ha encontrado una ubicación satisfactoria, pues por su estructura electrónica le corresponde el grupo I, pero sus propiedades se asemejan más al grupo 17. Entonces, generalmente se lo presenta en el grupo I, algo separado de los otros elementos de ese grupo para indicar las diferencias expuestas.
-Los metales se encuentran a la izquierda de la tabla. El primer elemento de cada período (Li, Na, K, etc.) presenta carácter metálico muy evidente, el cual disminuye a medida que se avanza horizontalmente hacia la derecha, mientras se van manifestando las características propias de los no metales. Los elementos del grupio 17 son francamente no metales..
-Una línea quebrada que pasa por el boro y el aluminio y desciende hasta el polonio y el astato señala la separación entre metales y no metales.
-A partir de su ubicación en la tabla, se puede deducir la estructura atómica del elemento.
-Los elementos situados después del uranio, reciben el nombre de transuránidos. Estos elementos no existen en la Naturaleza y han sido obtenidos artificialmente por reacciones nucleares.
CLASIFICACIÓN DE LOS ELEMENTOS SEGÚN SU CONFIGURACIÓN ELECTRÓNICA
Sobre la base de su configuración electrónica, los elementos químicos se pueden clasificar en cuatro grupos:
a) GASES INERTES: presentan su órbita electrónica externa completa con ocho electrones, con excepción del He, que tiene 2 electrones. En ellos, la estructura electrónica externa es s2 p6, salvo en el He, que es s2 por tener un solo nivel de energía.
b) ELEMENTOS REPRESENTATIVOS: son aquellos que tienen el último electrón en los subniveles s o p. Comprende a los elementos que ocupan los grupos 1, 2, 13, 14, 15, 16 y 17 de la Tabla Periódica.
c) ELEMENTOS DE TRANSICIÓN: son los que tienen el último electrón en los subniveles d. Corresponden a esta clase los elementos de los grupos 3 al 12 de la Tabla.
d) ELEMENTOS DE TRANSICIÓN INTERNA : en ellos el último electrón se halla en el subnivel f. Constituyen las llamadas tierras raras (lantánidos y actínidos) ubicados generalmente al pie de la Tabla.
b) ELEMENTOS REPRESENTATIVOS: son aquellos que tienen el último electrón en los subniveles s o p. Comprende a los elementos que ocupan los grupos 1, 2, 13, 14, 15, 16 y 17 de la Tabla Periódica.
c) ELEMENTOS DE TRANSICIÓN: son los que tienen el último electrón en los subniveles d. Corresponden a esta clase los elementos de los grupos 3 al 12 de la Tabla.
d) ELEMENTOS DE TRANSICIÓN INTERNA : en ellos el último electrón se halla en el subnivel f. Constituyen las llamadas tierras raras (lantánidos y actínidos) ubicados generalmente al pie de la Tabla.
ACTIVIDADES DE RECONOCIMIENTO
Copiar en la carpeta y resolver:
1) Señale que se entiende por:
a) Período: .........................................................................
b) Grupo: ..........................................................................
2) Señale que tienen en común los elementos de un mismo:
a) Grupo: ...........................................................................
b) Período: .........................................................................
3) Indique cuáles son las características de los:
a) Gases inertes: ...........................................................................
b) Elementos representativos: .............................................................................
c) Elementos de transición: ................................................................................
d) Elementos de transición interna: ..........................................................................
ACTIVIDADES DE RAZONAMIENTO
1) Ubique en la clase que corresponda a los siguientes elementos: Ca, Fe, Ag, Al, Ar, Ni, Tb, U, Cl, Mo, Li, S, Ne.:
a) Gases inertes: ......................................................................
Justifique: ..............................................................................
b) Elementos representativos: ....................................................................
Justifique: ..............................................................................
c) Elementos de transición: ...................................................................
Justifique: ......................................................................................
d) Elementos de transición interna: .................................................................
Justifique: ......................................................................................
http://www.quimitube.com/videos/variacion-radio-atomico-y-radio-ionico-tabla-periodica
Radio atómico y radio iónico
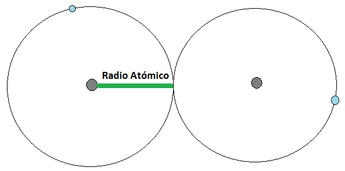
- Radio Atómico: El radio atómico se define como la distancia que existe entre el centro del núcleo de un átomo y la órbita de electrones más externa . Imágen 12 (a) .
Imágen 12: Radio Atómico. Las pelotas grises son los núcleos atómicos, mientras las bolas celestes son el electrón mas externo.
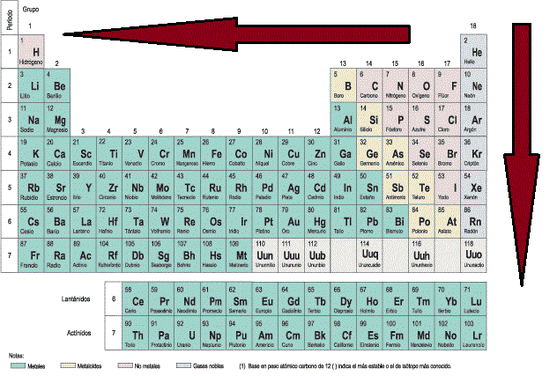
El radio atómico aumenta a medida que se aumenta en el período y
a medida que se baja en el grupo (Imágen 13).
Imágen 13: Direcciones hacia donde aumenta el Radio Atómico.
Imágen 13: Direcciones hacia donde aumenta el Radio Atómico.
a) En un mismo período de la Tabla Periódica el radio atómico aumenta de derecha a izquierda.
El modo como varía el radio atómico se atribuye a la carga nuclear. Al ser mayor la carga nuclear, a la derecha, los electrones que están en la misma órbita son atraídos con mayor intensidad por el núcleo y entonces el radio disminuye. Al contrario, a la izquierda, al ser menor la carga nuclear, los electrones que están en la misma órbita son atraídos con menor intensidad por el núcleo y entonces el radio aumenta.
b) En un mismo grupo de la Tabla Periódica, el radio atómico aumenta de arriba hacia abajo. Este incremento es consecuencia del aumento del número de órbitas.
Comprobar esto en la tabla interactiva del siguiente link.
http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/tabla_period/tabla.htm
RADIO IÓNICO
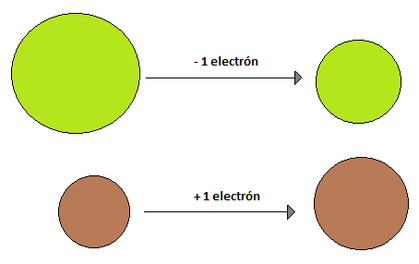
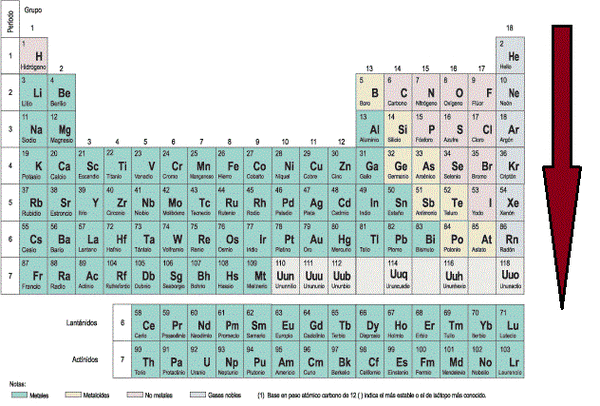
- Radio Iónico: El radio iónico se define en relación a iones. Un ión es una especie química con carga, ya sea esta positiva o negativa, y se originan debido a que los elementos tratan de parecerse al gas noble más cercano (elementos del grupo 18), ya que estos tienen una estabilidad sueprior debido a que sus niveles energéticos se encuentran completos. El término ión significa "ir hacia" y hace referencia a un circuito eléctrico, es por eso que las sustancias cargadas positivamente se llaman cationes (van hacia el cátodo , polo negativo) y las sustancias cargadas negativamente se llaman aniones (van hacia el ánodo, polo positivo). Pero, ¿qué hace que exista esta especie química cargada? La respuesta es la ganancia o pérdida de electrones. Como un átomo es electricamente neutro, cuando, por ejemplo, gana un electrón de más queda con cargado con un -1 mientras que si pierde un electrón queda cargado con un +1. La capacidad de un átomo para ganar o perder electrones esta dado por su electronegatividad, electropositividad, energía de ionización y electroafinidad (propiedades que se verán más adelante). El radio iónico de una especie que ha perdido un electrón es menor que el radio atómico original, esto se debe a que como existe una carga positiva más que negativas, los electrones se sienten mucho mas atraídos hacia el núcleo, reduciendo el radio. Por su parte, cuando un elemento gana un electrón, su radio iónico es mayor que su radio atómico de origen, debido a que ese último electrón que entró no se encuentra tan atraído hacia el núcleo y hace aumentar el radio (Imágen 14). El radio iónico, al igual que su par atómico, aumenta a medida que se "baja" en un grupo, pero a diferencia del radio atómico, no presenta una tendencia clara de crecimiento en un periodo, ya que depende del ión (y algunos elementos tienen más de un ión posible, como Cu, Fe, Mn, etc.) (Imágen 15).
Imágen 14: Comparaciones entre los radios iónicos (derecha) con respecto a sus radios atómicos originales, (izquierda) para un elemento cualquiera que gane un electrón y otro cualquiera que pierda uno.
Imágen 15: Dirección hacia donde aumenta el radio iónico en la tabla periódica.


No hay comentarios:
Publicar un comentario